Giải bài tập hóa lớp 10
Xem tổng thể tài liệu Lớp 10: tại đây
Giải bài bác Tập chất hóa học 10 – bài bác 30: diêm sinh giúp HS giải bài bác tập, cung ứng cho những em một hệ thống kiến thức và hình thành thói quen học tập làm việc khoa học, làm căn nguyên cho việc phát triển năng lượng nhận thức, năng lượng hành động:
Bài 1 (trang 132 SGK Hóa 10): lưu giữ huỳnh công dụng với aixt sunfuric đặc, nóng:S + 2H2SO4 → 3SO2 + 2H2O
Trong bội phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị thoái hóa là:
A. 1 : 2.
Bạn đang xem: Giải bài tập hóa lớp 10
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.
Chọn đáp án đúng.
Lời giải:
D đúng.
S là chất khử (chất bị oxi hóa) ⇒ Số nguyên tử S bị oxi hóa là một trong những
H2SO4 là hóa học oxi hóa (chất bị khử) ⇒ Số nguyên tử S bị khử là 2
⇒ tỉ lệ số nguyên tử S bị khử: số nguyên tử S bị oxi hóa là: 2:1
Bài 2 (trang 132 SGK Hóa 10): Dãy đối chọi chất nào sau đây vừa gồm tính lão hóa vừa bao gồm tính khử?A. Cl2 , O3, S.
Xem thêm: Cauldron Of Resistance: Ngo Dinh Diem, The United States, And 1950S Southern
B. S, Cl2, Br2.
C. Na, F2, S.
D. Br2, O2, Ca.
Lời giải:
B đúng.
Bài 3 (trang 132 SGK Hóa 10): hoàn toàn có thể dự đoán sự thay đổi như cầm nào về cân nặng riêng, về ánh nắng mặt trời nóng tung khi giữ lại lưu huỳnh solo tà (SB ) lâu năm ngày ở ánh nắng mặt trời phòng?Lời giải:
Ở ánh sáng phòng, tất cả sự đưa hóa từ bỏ Sβ → Sα vậy khi duy trì Sβ vài ngày ở nhiệt độ phòng thì:
– cân nặng riêng của lưu huỳnh tăng dần.
– ánh nắng mặt trời nóng tan của lưu lại huỳnh giảm dần.
Bài 4 (trang 132 SGK Hóa 10): Đun rét một tất cả hổn hợp gồm gồm 0,650g bột kẽm và 0,224g bột lưu huỳnh trong ống thử đậy kín không có không khí. Sau phản nghịch ứng, người ta thu được chất nào vào ống nghiệm? khối lượng là bao nhiêu?Lời giải:
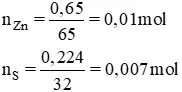
⇒ S phản bội ứng hết, Zn làm phản ứng dư
Phương trình chất hóa học của bội phản ứng
Zn + S
nZn bội phản ứng = 0,007 mol ⇒ nZnS = 0,007 mol.
Khối lượng các chất sau làm phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.
Bài 5 (trang 132 SGK Hóa 10): 1,10g các thành phần hỗn hợp bột sắt cùng bột nhôm chức năng vừa đủ với 1,28g bột lưu lại huỳnh.a) Viết những phương trình hóa học của bội nghịch ứng xảy ra.















